栏目:临床医学
直接抗病毒药物治疗肝/肾移植术后丙型肝炎疗效及安全性研究
收稿日期:
2019-01-07
录用日期:
2019-05-10
网络出版日期:
2019-09-01
基金项目:四川省重点研发项目 2018SZ0137
摘要:目的观察直接抗病毒药物治疗肝/肾移植术后丙型肝炎病毒(HCV)感染患者的疗效和安全性。方法回顾性纳入2015年7月至2018年1月收治的肝/肾移植术后丙型肝炎患者12例,HCV基因型均为1b,给予sofosbuvir为基础的直接抗病毒药物治疗12周或24周,随访治疗效果及不良反应。结果12例患者均在治疗结束时HCV-RNA低于检测下限,1例患者停药12周复发,治疗结束后12周持续的病毒学应答(SVR12)率为91.7%(11/12)。肾移植组患者丙氨酸氨基转移酶(ALT)、天冬氨酸氨基转移酶(AST)在治疗前后差异有统计学意义(P<0.05),肝移植组ALT、AST亦有所改善(P<0.05),肝/肾移植组中总胆红素(TBIL)、白蛋白(ALB)、肌酐(CR)及他克莫司血药浓度(TAC)均无明显改变。最常见的不良反应为疲乏(25.0%)及胆红素一过性升高(25.0%)。1例患者出现肾功能恶化,其原因不排除与抗病毒治疗有关。结论以sofosbuvir为基础的直接抗病毒药物治疗肝/肾移植术后丙型肝炎患者,疗效佳,不良反应轻微,但治疗期间和HCV清除后均应密切监测肝肾功及免疫抑制剂浓度,警惕药物相互作用或急慢性排斥反应的反生。
Column:Clinical Medicine
全文HTML
丙型病毒性肝炎是一种主要经血液传播的传染病,呈全球性流行。2015年全球有7 100万人感染丙型肝炎病毒(hepatitis C virus,HCV),近40万人死于HCV相关的肝硬化或肝癌,并有175万新发HCV感染病例[1]。中国2017年丙型病毒性肝炎新发报告约21.4万例,其病死率约为0.008 7/10万[2]。
肾病患者的HCV感染率上升,而且肾移植受者常经血液透析和血制品输注等途径感染HCV。肾移植术后HCV感染可能与肝纤维化加速进展有关,是发生肝硬化、肝癌和死亡的高危因素[3],也与术后蛋白尿、移植后肾病、新发糖尿病、慢性排斥反应以及移植物失功有关[3-4]。肝移植术后HCV感染大多源于术后体内残留的HCV重新复制,小部分来源于供肝或输血途径(10%~30%)。感染HCV的移植受体肝脏纤维化进展加速,近20%~40%的患者在移植后5年内进展为肝硬化,导致进展性肝病的发病率、患者死亡率和移植失败率增加[5]。肝/肾移植术后HCV感染的治疗一直是临床上的棘手问题。对于肾移植术后HCV感染患者来说,干扰素和利巴韦林有引起急性排斥反应的风险,从而导致移植物失功,降低移植物受体存活率[6],因此干扰素在肾移植受者中是相对禁忌的。肝移植受者既往使用干扰素和利巴韦林治疗48~72周后,持续病毒学应答(sustained virologic response,SVR)率约30%,且具有显著的副作用[7]。因此,含干扰素的方案已基本不再应用于移植后受者。
新型直接抗病毒药物(direct-acting antiviral agents,DAA)的兴起,为肝/肾移植术后HCV感染的治疗带来巨大的希望。目前国内少有肝/肾移植术后患者应用DAA的临床报道。本研究收集12例肝/肾移植术后HCV感染患者,观察分析其经DAA治疗的疗效及安全性,期望为临床治疗提供经验指导。
1.
资料与方法
1.1.
研究对象
回顾性纳入2015年7月至2018年1月在四川大学华西医院感染疾病中心门诊收治的肝/肾移植术后HCV感染者12例,其中3例肝移植,9例肾移植,均接受了以sofosbuvir(SOF)为基础的直接抗病毒药物治疗。所有患者符合2015年《丙型肝炎防治指南》[8]中慢性丙型肝炎的诊断标准。本研究所指的肝/肾移植后丙型肝炎患者主要为术后复发的患者,少数因手术或输血等途径感染。
1.2.
抗病毒治疗方案
治疗方案为SOF联合ribavirin(RBV)、ledipasvir(LED)、daclatasvir(DAC)或velpatasvir(VEL):SOF 400 mg/d+RBV 900 mg/d或SOF 400 mg/d+LED 90 mg/d或SOF 400 mg/d+DAC 60 mg/d或SOF 400 mg/d+VEL 100 mg/d治疗,疗程为12周或24周。DAA药物均为患者自行购买,产地主要为印度,品牌为NATCO或Mylan, 少量SOF/VEL药物产地为孟加拉,生产企业Incepta。所有患者治疗前均已知风险并签署知情同意书。
1.3.
免疫抑制方案及其他伴随药物
在抗病毒治疗期间,12例患者采用的免疫抑制药物一般为他克莫司(TAC)、吗替麦考酚酯(MMF)、强的松(短期使用)及环孢菌素(CsA)等(患者伴随药物见表 1)。治疗过程中,11例患者监测TAC的质量浓度,1例患者(编号10)监测CsA的质量浓度。其中6例患者合并慢性乙型肝炎病毒感染,术后予以抗乙肝病毒治疗,6例患者考虑高血压,给予适当降压治疗。
移植术
| 编码
| 免疫抑制药物
| 其他药物
| RVR
| ETVR
| SVR12
|
LT
| 1
| TAC、MMF
| 恩替卡韦
| 否
| 是
| 否
|
LT
| 2
| TAC、MMF
| -
| 否
| 是
| 是
|
LT
| 3
| TAC、MMF
| 恩替卡韦
| 是
| 是
| 是
|
RT
| 4
| TAC、MMF
| -
| 是
| 是
| 是
|
RT
| 5
| TAC、MMF
| 拉米夫定
| 是
| 是
| 是
|
RT
| 6
| TAC、MMF、强的松
| 恩替卡韦、缬沙坦
| 是
| 是
| 是
|
RT
| 7
| TAC、MMF、强的松
| 恩替卡韦、非洛地平
| 是
| 是
| 是
|
RT
| 8
| TAC、MMF
| 缬沙坦
| 是
| 是
| 是
|
RT
| 9
| TAC、MMF、强的松
| 拉米夫定
| 是
| 是
| 是
|
RT
| 10
| CsA、MMF
| 缬沙坦
| 是
| 是
| 是
|
RT
| 11
| TAC、MMF
| 厄贝沙坦
| 是
| 是
| 是
|
RT
| 12
| TAC、MMF
| 厄贝沙坦
| 是
| 是
| 是
|
LT:肝移植;RT:肾移植;RVR:快速病毒学应答;ETVR:治疗结束时病毒学应答;SVR12:治疗结束后12周持续的病毒学应答
|
1.4.
观察指标
治疗前检查HCV-RNA、基因型、血常规、肝肾功能、免疫抑制剂浓度。观察用药2周、4周、治疗结束(12周或24周),停药4周、12周患者的HCV-RNA、免疫抑制剂血药浓度、血常规、肝肾功以及影像学资料等。疗效指标:快速病毒学应答(rapid virological response, RVR)即抗病毒治疗后4周时血清HCV-RNA低于可检测水平;治疗结束时病毒学应答(end treatment virological response, ETVR)即抗病毒治疗结束时HCV-RNA低于可检测水平;治疗结束后12周持续的病毒学应答(sustained virological response at 12 weeks post-treatment,SVR12)即治疗结束后第12周HCV-RNA不可测。采用RT-PCR(罗氏)检测血清中HCV-RNA载量。HCV-RNA载量最低检测值为15 IU/mL。
1.5.
统计学方法
计数资料以百分率描述。计量资料行Shapiro-Wilk正态性检验,服从正态分布的计量资料用x±s表示,采用自身配对t检验分析治疗前后指标差异性,呈非正态分布的计量资料用中位数(P25,P75)表示,采用自身配对Wilcoxon秩和检验分析治疗前后指标差异性。P< 0.05为差异有统计学意义。
2.
结果
2.1.
一般资料
12例患者中女性3例,男性9例;年龄41~53(48.33±4.44)岁。平均基线HCV-RNA载量8.6×106IU/mL,病毒基因型均为1b。移植术后至开始抗病毒治疗时间3~195月(中位时间60.5月)。具体人口学特征及基本临床特征见表 2。
移植术
| 编号
| 性别
| 年龄/岁
| 肝硬化
| PR史
| 基线HCV-RNA/
(IU/mL)
| 方案
| 疗程/周
| 移植后开始抗病
毒治疗时间/月
|
LT
| 1
| 男
| 52
| 无
| 有
| 2.95×107
| SOF+RBV
| 24
| 25
|
LT
| 2
| 女
| 44
| 无
| 无
| 9.85×105
| SOF+RBV
| 24
| 3
|
LT
| 3
| 男
| 52
| 无
| 有
| 2.07×107
| SOF+DAC
| 24
| 36
|
RT
| 4
| 女
| 52
| 有
| 无
| 4.18×106
| SOF+RBV
| 24
| 28
|
RT
| 5
| 男
| 46
| 无
| 无
| 2.03×106
| SOF+LED
| 12
| 19
|
RT
| 6
| 女
| 46
| 无
| 无
| 2.43×106
| SOF+DAC
| 12
| 195
|
RT
| 7
| 男
| 41
| 无
| 无
| 3.60×106
| SOF+DAC
| 12
| 35
|
RT
| 8
| 男
| 51
| 无
| 无
| 1.98×106
| SOF+DAC
| 12
| 125
|
RT
| 9
| 男
| 53
| 无
| 无
| 1.58×106
| SOF+DAC
| 12
| 105
|
RT
| 10
| 男
| 53
| 无
| 无
| 7.65×105
| SOF+DAC
| 12
| 180
|
RT
| 11
| 男
| 46
| 无
| 无
| 2.90×107
| SOF+VEL
| 12
| 150
|
RT
| 12
| 男
| 43
| 无
| 无
| 6.70×106
| SOF+VEL
| 12
| 85
|
LT:肝移植;RT:肾移植;PR:聚乙二醇干扰素联合利巴韦林方案
|
2.2.
生化指标及免疫抑制剂浓度
结果见图 1。肾移植组患者在治疗4周、治疗结束及停药12周的丙氨酸氨基转移酶(ALT)、天冬氨酸氨基转移酶(AST)与治疗基线比较均下降,且其差异均有统计学意义(P< 0.05),肝功能明显改善,总胆红素(tb)、白蛋白(alb)、血肌酐(cr)及他克莫司血药浓度(tac)等指标变化无统计学意义,患者(编号10)csa的浓度未见明显变化。肝移植组肝功能(alt、ast)亦有所改善,且与肾移植组类似,治疗4周、治疗结束及停药12周的alt、ast与治疗基线比较均下降,且其差异均有统计学意义(P< 0.05),其余指标无明显变化。
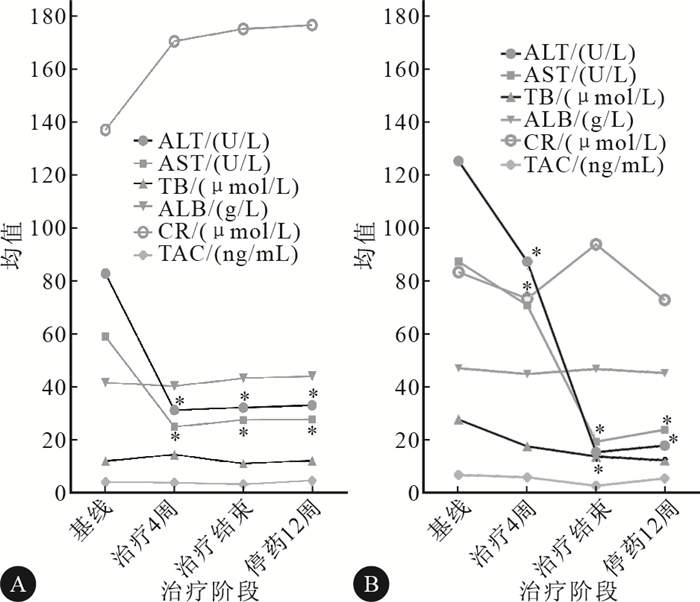
图 1肾移植术后(A)和肝移植术后(B)抗丙肝治疗患者在不同治疗阶段的肝功能、肾功能、免疫抑制剂血药浓度的变化趋势*P< 0.05,与基线比较
2.3.
病毒学应答
结果见表 1、图 2。在治疗4周时,33.3%的肝移植患者和100%的肾移植患者HCV-RNA低于检测下限。所有患者在治疗结束时HCV-RNA均低于检测下限。SVR12率为91.7%(11/12)。未达到RVR的2例患者(编号1和2)在治疗8周时HCV-RNA低于检测下限。1例患者(编号1)在停药12周时复发,之后该患者接受SOF+DAC治疗后得以治愈,随访18月未复发。
2.4.
不良反应
包括临床不良反应和生化指标异常。其中,临床不良反应包括疲乏(3例,25.0%)、头痛(1例,8.3%)、腹泻(1例,8.3%)、瘙痒(1例,8.3%)、恶心(1例,8.3%),生化指标异常包括贫血(2例,16.7%)、白细胞减少(2例,16.7%)、血小板减少(1例,8.3%)、胆红素一过性升高(3例,25.0%)、肌酐升高(2例,16.7%),最常见的不良反应为疲乏及胆红素一过性升高。1例患者(编号9)抗病毒治疗后肌酐明显上升,停药后肾功能进行性恶化,停药2年时死亡,其他患者发生的不良反应程度轻微,且均在治疗结束后恢复。
3.
讨论
肝/肾移植术后丙型肝炎复发较常见,清除HCV感染对降低术后并发症、提高生命质量及减少死亡率等至关重要。对于HCV感染者,干扰素方案因疗效欠佳、耐受性差等原因已逐渐不再使用于肝/肾移植术后HCV感染患者。DAA的应用,为肝/肾移植术后使用免疫抑制剂的HCV感染患者带来了希望。
全球公认的HCV基因型有6种,我院以1b、1、3b、2a、3a、6a基因型/亚型为主,4型极少见,HCV主要基因型/亚型在不同年龄段均以1b型占优势[9]。肝/肾移植的HCV感染患者最常见的基因型也为1b。本研究中所有患者病毒基因型亦均为1b。
随着DAA的研发和应用进展,截至2018年5月,美国食品药品管理局(FDA)或欧洲药品管理局(EMA)已批准了13种DAA药物[10]。目前已上市的DAA根据作用靶点不同,可分NS3/4蛋白酶抑制剂(如glecaprevir、voxilaprevir、grazoprevir、paritaprevir、simeprevir和elbasvir)、NS5A复制复合物抑制剂(DAC、VEL、LED、ombitasvir和pibrentasvir)和NS5B(RNA-依赖性RNA聚合酶)抑制剂(SOF和Dasabuvir)。2013年泛基因型药物SOF被批准用于一般HCV感染的治疗,且以SOF为基础的DAA方案在我国应用最为广泛。本研究根据当时指南推荐、药物可及性及患者个人情况,推荐的抗病毒治疗方案主要是SOF+RBV或SOF +LED或SOF+DAC或SOF+VEL。最新的2018年欧洲肝脏研究学会(EASL)指南[11]建议所有移植后HCV感染复发的患者均应考虑进行治疗,肾移植受者建议给予SOF和LED(基因型1, 4, 5和6),或使用SOF和VEL(所有基因型)。若移植后受者估算肾小球滤过率(eGFR)<30 ml/(min·1.73 m2),可用固定剂量的glecaprevir和pibrentasvir组合治疗12周。肝移植后HCV复发无肝硬化、或伴代偿(Child-Pugh A)肝硬化或失代偿(Child-Pugh B或C)肝硬化的患者治疗方案同上,但肝移植后HCV复发伴失代偿(Child-Pugh B或C)肝硬化的患者建议在应用SOF/LED或SOF/VEL方案的基础上添加利巴韦林。
本研究总体SVR12率为91.7%,经过治疗肝功能普遍得以改善,除1例患者发生肾功能恶化外,其他患者不良反应轻微,最常见的不良反应为疲乏及胆红素一过性升高;既往文献[12-15]报道以SOF为基础的DAA方案治疗肝/肾移植术后HCV患者,其SVR12率达90%以上,且不良反应率低,与本研究结果相似。值得注意的是本研究中1例患者(编号9)在肾移植术后5年发现肌酐轻度上升,肾脏穿刺病理提示慢性抗体介导性排斥反应,术后7年再次开始血液透析,术后8年自愿服用SOF+DAC抗HCV治疗〔基线eGFR为16.8 mL/(min·1.73 m2)〕,治疗过程免疫抑制剂浓度稳定,但肾功能进行性恶化,停药2年时死于“曲霉菌肺炎、巨细胞病毒性肺炎、呼吸循环衰竭”。患者肾功能恶化的原因除可能与发生急慢性排斥反应、肾移植术后继续血液透析效果欠佳及反复肺部感染等因素有关外,还可能与SOF+DAC药物因素(治疗期间肌酐上升)有关。在目前FDA批准的DAA中,只有SOF主要通过肾脏清除(大约80%)。2018年欧洲肝病指南[11]提出,仅当严重肾功能不全患者〔eGFR<30 mL/(min·1.73 m2)〕无可用获批治疗药物时,才考虑应用SOF。虽然关于SOF在终末期肾病中安全使用的研究[14]越来越多,但临床上仍需进一步的大样本研究来指导应用。
在使用DAA治疗移植术后HCV感染的患者中应考虑药物的相互作用,特别是与免疫抑制剂的相互作用。用于移植后免疫抑制的有钙调神经磷酸酶抑制剂(CNIs)(TAC和CsA)和哺乳动物雷帕霉素靶抑制剂(mTORi)(西罗莫司和依维莫司),是细胞色素(CYP)P450同工酶3A4和药物转运蛋白P-糖蛋白(P-gp)的底物。本研究中肝/肾移植患者,在治疗过程中以及治疗后12周,未报道与CNIs(TAC、CsA)之间有明显药物相互作用,免疫抑制剂浓度较稳定,未调整剂量。有关DAA与免疫抑制剂间的相互作用,文献报道不一致[16-20]。2016年欧洲肝脏研究学会(EASL)[21]提出采用SOF和LED、SOF和VEL或SOF和DAC方案联合治疗的患者,不需要调整免疫抑制药物的剂量(依维莫司很可能例外)。总之,我们建议在抗病毒治疗期间和HCV清除后都应该监测免疫抑制剂浓度,必要时调整其剂量,以避免排斥反应发生。
本研究尚存不足:样本量偏少;研究采用回顾性观察分析,治疗方案的选择主要依据患者病情、药物可及性及当时指南推荐的最佳治疗方案,因此药物组合、治疗起始时间、治疗周期的选择可能有微小差异,限制了不同治疗方案之间准确的直接比较。
综上所述,以SOF为基础的新型全口服直接抗病毒方案,在我国肝/肾移植术后HCV感染患者中疗效较好,不良反应轻微,但需要密切随访肝肾功,警惕药物相互作用。特别是肾功能较差的肾移植术后患者,警惕急慢性排斥反应、肾功能恶化的发生,密切监测免疫抑制剂浓度,必要时调整用量。
参考文献(21)
 关注分享
关注分享