海马静息态功能连接与创伤后应激障碍患者抑郁焦虑症状的关联研究
作者:王祖星, 袁敏兰, 朱鸿儒, 袁翠, 李雨辰, 邱昌建, 张伟
Author:, , , , , ,
收稿日期:2019-01-13 年卷(期)页码:2019,50(5):743-747
期刊名称:四川大学学报(医学版)
Journal Name:JOURNAL OF SICHUAN UNIVERSITY (MEDICAL SCIENCE EDITION)
关键字:创伤后应激障碍, 静息态功能连接, 海马, 抑郁, 焦虑
Key words:, , , ,
基金项目:
中文摘要
目的 检测创伤后应激障碍(posttraumatic stress disorder, PTSD)患者抑郁、焦虑症状与海马静息态功能连接(resting-state functional connectivity, rs-FC)的关系,探讨PTSD抑郁焦虑症状可能的神经病理机制。 方法 对60例未接受过治疗的地震PTSD患者进行功能磁共振扫描,4例被试因头动及图像质量原因排除。选取海马(hippocampus, HIP)、眶额叶皮质(orbitofrontal cortex, OFC)、脑岛(insula, INS)和丘脑(thalamus, THA)进行感兴趣区(region of interest, ROI)间的功能连接分析,基于Pearson相关系数(即rs-FC值)计算脑区间信号的相似性。分别提取回归全脑信号和未回归全脑信号的数据。采用多元线性回归模型研究抑郁、焦虑症状与HIP-THA、HIP-INS和HIP-OFC的rs-FC之间的关系。 结果 汉密尔顿焦虑量表(Hamilton anxiety scale, HAMA)评分在回归和未回归全脑信号的结果中与左侧HIP-左侧THA的rs-FC和左侧HIP-左侧OFC的rs-FC之间均呈正相关;汉密尔顿抑郁量表(Hamilton depression scale, HAMD)评分在回归和未回归全脑信号的结果中与左侧HIP-左侧THA的rs-FC、左侧HIP-左侧OFC的rs-FC和右侧HIP-左侧INS的rs-FC之间均呈负相关。 结论 海马相关环路的自发神经活动改变可能是PTSD患者焦虑和抑郁的脑神经机制之一,提示海马功能的恢复是缓解PTSD患者焦虑和抑郁症状的潜在靶点。
英文摘要
栏目:研究报告
海马静息态功能连接与创伤后应激障碍患者抑郁焦虑症状的关联研究
收稿日期:
2019-01-13
录用日期:
2019-05-15
网络出版日期:
2019-09-01
基金项目:国家自然科学基金 81371484国家重点研发项目 2016YFC1307201国家自然科学基金 81701328
摘要:目的检测创伤后应激障碍(posttraumatic stress disorder, PTSD)患者抑郁、焦虑症状与海马静息态功能连接(resting-state functional connectivity, rs-FC)的关系,探讨PTSD抑郁焦虑症状可能的神经病理机制。方法对60例未接受过治疗的地震PTSD患者进行功能磁共振扫描,4例被试因头动及图像质量原因排除。选取海马(hippocampus, HIP)、眶额叶皮质(orbitofrontal cortex, OFC)、脑岛(insula, INS)和丘脑(thalamus, THA)进行感兴趣区(region of interest, ROI)间的功能连接分析,基于Pearson相关系数(即rs-FC值)计算脑区间信号的相似性。分别提取回归全脑信号和未回归全脑信号的数据。采用多元线性回归模型研究抑郁、焦虑症状与HIP-THA、HIP-INS和HIP-OFC的rs-FC之间的关系。结果汉密尔顿焦虑量表(Hamilton anxiety scale, HAMA)评分在回归和未回归全脑信号的结果中与左侧HIP-左侧THA的rs-FC和左侧HIP-左侧OFC的rs-FC之间均呈正相关;汉密尔顿抑郁量表(Hamilton depression scale, HAMD)评分在回归和未回归全脑信号的结果中与左侧HIP-左侧THA的rs-FC、左侧HIP-左侧OFC的rs-FC和右侧HIP-左侧INS的rs-FC之间均呈负相关。结论海马相关环路的自发神经活动改变可能是PTSD患者焦虑和抑郁的脑神经机制之一,提示海马功能的恢复是缓解PTSD患者焦虑和抑郁症状的潜在靶点。
全文HTML
创伤后应激障碍(posttraumatic stress disorder, PTSD)是暴露于创伤事件后最常见的精神心理疾病。PTSD的终生患病率随社会背景和居住国的不同而变化,从1.3%到12.2%不等[1]。研究报道抑郁障碍和焦虑障碍在PTSD人群中有很高的发生率,且PTSD伴抑郁、焦虑会导致PTSD的疗效更差,增加PTSD患者的自杀风险[2]。目前抑郁症状和焦虑症状在PTSD人群中的神经病理机制尚不清楚。既往大脑功能影像研究表明海马(hippocampus, HIP)、眶额叶皮质(orbitofrontal cortex, OFC)、脑岛(insula, INS)和丘脑(thalamus, THA)等多个脑区在抑郁、焦虑中扮演着重要的角色[3-5]。其中海马的功能异常被认为是PTSD特征性症状的生物学机制之一[6]。因此,PTSD患者的焦虑抑郁症状可能与海马功能存在联系。然而目前对抑郁、焦虑的脑影像研究多聚焦于重性抑郁和焦虑障碍,尚不清楚在PTSD患者中海马功能与焦虑和抑郁症状的关系。
静息态功能连接(resting-state functional connectivity, rs-FC)刻画的是在静息态下大脑各个脑区自发低频活动的同步性[7],提供了用功能磁共振成像研究大脑不同脑区之间功能连接的方法。rs-FC值与临床症状的关系可能反映了相关脑区神经环路之间活动的变化,并可能是临床症状的神经病理机制。因此,本研究运用海马的rs-FC研究未经治疗的PTSD患者抑郁、焦虑症状的神经环路,为其干预提供可能的靶点。
1.
对象和方法
1.1.
研究对象
2014年12月至2016年12月期间收集的5.12地震重灾区创伤后幸存者60例,纳入标准:①创伤的来源为汶川地震;②经过《DSM-Ⅳ-TR轴Ⅰ障碍定式临床检查病人版》(SCD-P)定式评估,诊断为PTSD;且PTSD诊断量表[8](Clinician Administered PTSD Scale, CAPS)得分≥40分;③未接受正规心理治疗和药物治疗;④均为右利手;⑤年龄18~65岁。排除标准:①有创伤引起的脑损伤或意识障碍;②经过《DSM-Ⅳ-TR轴Ⅰ障碍定式临床检查病人版》(SCD-P)定式评估,在地震前被诊断为双相障碍、精神分裂症或分裂情感性障碍,物质相关及成瘾障碍;③怀孕;④患有其他主要身体疾病。
本研究通过四川大学华西医院伦理委员会批准〔2014年审(108)号〕,所有被试者在入组前均对本研究知情,并签署知情同意书。
1.2.
方法
1.2.1.
临床评定
由2名精神科医师使用CAPS独立评定每个被试者的临床PTSD症状严重程度,并用汉密尔顿焦虑量表[9](Hamilton anxiety scale, HAMA)和汉密尔顿抑郁量表[10](Hamilton depression scale, HAMD)评定被试1周前的情绪状态,每项评分先取2名医师评定的平均分后,再四舍五入为整数,评分越高,症状越严重。
1.2.2.
扫描图像的获得
采用8通道线圈3.0 T磁共振成像系统(3.0 T,德国西门子公司)采集图像。图像数据采用回波平面成像(echo plane imaging, EPI)脉冲序列(扫描参数如下:重复时间2 000 ms,回波时间30 ms,视野240 mm×240 mm,分辨率64×64,翻转角90°,轴位32层,层厚5 mm,无间隔)。每个被试均采集205个时间点,扫描时瞩被试不要动、保持清醒、平静心绪,固定被试头部并最大限度地减少其头部与身体的运动。
1.2.3.
图像预处理
本研究在Matlab2013b (The Mathworks Inc, USA)平台上,采用Data Processing Assistant for Resting-State fMRI (DPARSF_V4.3;http://rfmri.org/DPARSF)[11]对功能影像数据进行预处理。首先去除5个时间点,进行时间点的矫正。然后对所有图像进行头动矫正。接下来将脑脊液、白质信号回归掉以减少生理影响。之后将功能图像标准化到蒙特利尔神经病学研究所(Montreal Neurological Institute,MNI)标准空间,标准化后体素的大小为3 mm×3 mm×3 mm。对标准化后的图像进行高斯平滑,平滑核半高宽=6 mm。采用数据用滤波器提取0.01~0.08 Hz数据低频振荡信号部分。最后,为最小化头动的影响去除不稳定的时间点,并回归掉超过阈值的时间点。分别提取回归全脑信号和未回归全脑信号的数据进行独立分析。最终排除了3例头动平移超过3 mm、转动超过3°和1例功能图像mask未能遮盖超过95%群组mask的被试。
1.2.4.
rs-FC分析
基于Pearson相关系数计算脑区间信号的相似性,计算公式如下:
$ {R_{XY}} = \frac{{\sum {(X - \overline X )(Y - \overline Y )} }}{{\sqrt {\sum {{{(X - \overline X )}^2}{{(Y - \overline Y )}^2}} } }} $
|
其中,X和Y是两个脑区的功能磁共振信号,X和Y是这两个脑区信号的均值,RXY是X与Y信号的Pearson相关系数,即rs-FC值。从Harvard-Oxford图谱中选取HIP、OFC、INS和THA进行感兴趣区(region of interest, ROI)间的功能连接分析。所有rs-FC值都经过FisherZ变换。
1.2.5.
统计学方法
采用多元线性回归模型分析焦虑、抑郁症状(分别以HAMA和HAMD评分作为因变量)与HIP-THA、HIP-INS和HIP-OFC的rs-FC值,CAPS评分,HAMA/MAMD评分,年龄,教育年限和性别之间的关系。自变量选择采取强制纳入法。使用TCH(Tukey, Ciminera and Heyse)校正[12]对回归方程及自变量斜率的显著性进行多重比较矫正,各个ROI之间均进行了左右两侧共24次分析,显著水平设为P≤0.01。
2.
结果
2.1.
一般人口学资料
最后进行统计分析的56例研究对象中,男性12例,女性44例,平均年龄(45.7±6.6)岁,教育年限(9.9±3.3)年。临床量表得分情况:CAPS(70.0±19.8)分,HAMA(14.8±7.1)分,HAMD(16.4±7.1)分。其中根据精神障碍诊断统计手册(diagnostic and statistical manual of mental disorder,DSM:):13例目前为重性抑郁障碍,3例既往患重性抑郁障碍,2例为广泛性焦虑障碍,1例为惊恐发作。
2.2.
多元线性回归结果
本研究分析了回归全脑信号和未回归全脑信号两种情况,在两种情况中与HAMA和HAMD均显著相关的回归模型共有5个。HAMA为因变量的模型:HIP.L-THA.L,HIP.L-OFC.L;HAMD为因变量的模型:HIP.L-THA.L,HIP.L-OFC.L,HIP.R-INS.L。见图 1。
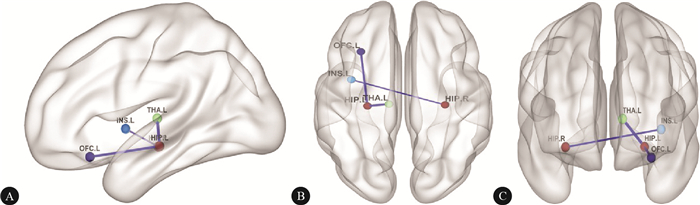
图 1在分别以HAMA和HAMD为因变量的多元回归模型中,HIP.L-THA.L、HIP.L-OFC.L、HIP.R-INS.L的功能连接与HAMA和HAMD评分间具有显著的相关性
2.2.1.
未回归全脑信号
HAMA评分作为因变量,海马不同功能连接值为自变量,有统计学意义的多元回归方程如下:HAMA=-15.452+9.792×rs-FC(HIP.L-THA.L)+0.853×HAMD(P<0.001,调整后R2=0.755);HAMA=-7.452+7.551×rs-FC(HIP.L-INS.L)+0.816×HAMD(P<0.001,调整后R2=0.725);HAMA=-9.692+9.661×rs-FC(HIP.L-OFC.L)+0.816×HAMD(P<0.001,调整后R2=0.757);HAMA=-13.524+8.627×rs-FC (HIP.R-THA.L)+0.874×HAMD(P<0.001,调整后的R2=0.748);HAMA=-6.839+8.688×rs-FC(HIP.R-INS.L) +0.837×HAMD(P<0.001,调整后的R2=0.743);HAMA=-7.716+9.172×rs-FC(HIP.R-OFC.L)+0.827×HAMD(P<0.001,调整后的R2=0.755)。各模型中HAMD评分与HAMA评分均呈正相关,而CAPS、年龄、教育年限和性别均不影响HAMA评分。
HAMD评分作为因变量,海马不同功能连接值为自变量,有统计学意义的多元回归方程如下:HAMD=17.716-10.237×rs-FC(HIP.L-THA.L)+0.840×HAMA(P<0.001,调整后的R2=0.757);HAMD=10.003-7.237×rs-FC(HIP.L-INS.L)+0.834×HAMA(P<0.001,调整后的R2=0.717);HAMD=12.081-9.317×rs-FC(HIP.L-OFC.L)+0.868×HAMA(P<0.001,调整后的R2=0.740);HAMD=15.992-9.501×rs-FC(HIP.R-THA.L)+0.815×HAMA(P<0.001,调整后的R2=0.764);HAMD=9.096-9.013×rs-FC(HIP.R-INS.L)+0.838×HAMA(P<0.001,调整后的R2=0.741);HAMD=10.074-9.107×rs-FC(HIP.R-OFC.L)+0.858×HAMA(P<0.001,调整后的R2=0.744)。各模型中HAMA评分与HAMD评分均呈正相关,而CAPS、年龄、教育年限和性别均不影响HAMA评分。
2.2.2.
回归全脑信号
HAMA评分作为因变量,海马不同功能连接值为自变量,有统计学意义的多元回归方程如下:HAMA=-11.762+9.870×rs-FC(HIP.L-THA.L)+0.655×HAMD(P<0.001,调整后的R2=0.694);HAMA=-5.742+9.661×rs-FC(HIP.L-OFC.L)+0.802×HAMD(P<0.001,调整后的R2=0.701)。各模型中HAMD评分与HAMA评分均呈正相关,而CAPS、年龄、教育年限和性别均不影响HAMA评分。
HAMD评分作为因变量,海马不同功能连接值为自变量,有统计学意义的多元回归方程如下:HAMD= 11.901-8.183×rs-FC(HIP.L-THA.L)+0.785×HAMA(P<0.001,调整后的R2=0.677);HAMD=8.465-8.125×rs-FC(HIP.L-OFC.L)+0.818×HAMA(P<0.001,调整后的R2=0.694);HAMD=9.928-9.012×rs-FC (HIP.R-INS.L)+0.819×HAMA(P<0.001,调整后的R2=0.674);HAMD=9.070-10.765×rs-FC(HIP.R-OFC.R)+0.834×HAMA(P<0.001,调整后的R2=0.695)。各模型中HAMA评分与HAMD评分均呈正相关,而CAPS、年龄、教育年限和性别均不影响HAMA评分。
3.
讨论
目前得到一致认可的是抑郁焦虑症状受到年龄、教育年限和性别的影响[13-14]。另外在功能磁共振研究中即使用专门计算方法来去除头动、脑脊液、白质信号等生理噪声后,剩余功能磁共振数据的全脑平均信号,仍包含了一部分真正的血氧合度依赖信号和一些噪声的残余。所以全脑平均信号的回归与否是功能磁共振研究领域一个容易引起争议的问题。根据目前国际通行的做法,本研究提供了回归与未回归全脑平均信号两种处理方法的结果,以便提供更全面的信息[15]。在回归与未回归全脑信号中,均发现相同的功能连接与HAMA和HAMD有关,说明本研究结果有较好的稳定性。
本研究显示HAMA评分与海马和丘脑的rs-FC值之间存在显著的正相关。海马与丘脑之间在功能上紧密相连[16]。任务态的功能连接研究表明随着焦虑水平的升高,海马和丘脑的活动也会增强[17]。另外,ARNOLD等[18]在关于社交焦虑症的rs-FC研究中发现,与健康对照相比,患者海马和丘脑的功能连接增强。丘脑参与诸如注意力、空间工作记忆等多种认知功能的调节[17],海马和丘脑的相互连接对于记忆至关重要[19]。本研究结果显示,功能连接越强焦虑症状越严重,这可能是海马与丘脑之间的功能连接增强导致的认知偏差的反映。
一项使用体内质子磁共振波谱的早期研究表明,健康人眶额叶皮质内N-乙酰天冬氨酸和谷氨酰胺这两种化学物质的总浓度与焦虑总分密切相关[20]。海马内N-乙酰天冬氨酸和谷氨酰胺的浓度也与焦虑症状之间有显著的关系[21]。本研究中HAMA评分与海马和眶额叶皮质的rs-FC值呈正相关,可能正是相关脑区神经递质浓度与焦虑症状关系在神经影像学的体现。
当前受到广泛认可的抑郁症神经病理机制主要是受边缘系统-皮质-纹状体-苍白球-丘脑环路的调节[22]。大量的证据表明,抑郁症与该环路的形态和功能密切相关。GUO等[23]的研究表明海马的度中心性和节点效率与HAMD评分呈显著负相关,而丘脑的度中心性和节点效率与HAMD评分呈显著正相关,眶额叶皮质通过抑制神经活动在情绪调节中起重要作用[24]。目前解释抑郁症状的一个假设是前脑多巴胺活性低下,导致边缘纹状体的去抑制,然后产生对腹侧苍白球的过度抑制,进而导致对涉及丘脑、眶额叶皮质和海马的兴奋回路的抑制[22]。本研究发现海马与丘脑及海马与眶额叶皮质的rs-FC值与HAMD评分呈负相关,在进一步证明了先前研究结果的同时,也提示海马与丘脑及海马与眶额叶皮质间的rs-FC值与HAMD评分呈负相关可能是多巴胺活性低下在海马rs-FC中的表现。
LUI等[25]的研究发现,与健康对照相比,抑郁症患者中海马与脑岛的rs-FC显著降低,但并未报道其与抑郁患者抑郁症状评分的关系。海马与脑岛是奖赏环路的重要组成部分[26],快感缺失、动机缺乏等抑郁症的核心症状与奖赏环路密切相关[27],rs-FC的研究中表明在抑郁症中奖赏环路的有效连接降低[28]。本研究发现,海马与脑岛的rs-FC值与HAMD评分呈负相关,提示奖赏环路受到抑制可能是抑郁症状的神经病理机制。
海马中的一氧化氮通路参与生物应激反应,对细胞和HPA轴反馈产生不利影响,而且海马萎缩和HPA轴反馈功能障碍与PTSD相关[29]。目前的研究认为一氧化氮通过影响γ-氨基丁酸和谷氨酸水平引起PTSD患者的焦虑、抑郁症状[29]。在PTSD患者中眶额叶皮质、脑岛和丘脑均有γ-氨基丁酸和谷氨酸水平的异常[30]。既往关于PTSD的rs-FC研究表明海马与眶额叶皮质的rs-FC较创伤对照组降低[31],海马与脑岛的rs-FC增强[32],一项Meta分析表明在PTSD患者中,丘脑与海马的活动较正常对照均显著减弱[33]。这些rs-FC和脑区活动的异常可能是上述神经递质在各脑区分布异常的表现。本研究的发现提示PTSD患者焦虑和抑郁症状与海马相关环路rs-FC的关系可能与相关脑区中γ-氨基丁酸和谷氨酸水平的异常有关。由于本研究未测定相关脑区的代谢情况,将来针对脑区代谢的磁共振波谱成像可能对印证该假设有重要价值。
本研究尚存不足之处。首先,本研究为横断面研究,只有被试基线的科研数据,如若有被试纵向的数据,则可根据受试者抑郁焦虑症状和其大脑的功能连接随时间的变化有无相关性来推测临床症状和生理指标之间的关系,这对评估日后的临床疗效有着重大意义。其次,缺乏患者体质量指数的数据,既往有研究报道该数值可能会对rs-FC值造成影响[34],纳入该数值可能会增强本研究回归模型的解释力度。最后,本研究纳入的女性被试比例较大,但在回归模型中加入了性别这一变量后,发现性别对模型无明显影响。
综上所述,本研究发现海马相关环路的自发神经活动改变可能是PTSD患者焦虑和抑郁的脑神经机制之一,提示海马功能的恢复是缓解PTSD患者焦虑和抑郁症状的潜在靶点。
参考文献(34)
 关注分享
关注分享
【关闭】